Isomerizzazione di acido maleico-fumarico
-
Chimica
-
Classi: 2° biennio e 5° anno
-
-
-
Laboratorio attrezzato
-
Osservazione
-
3 h
-
Min. 2 persone
-
Richiede precauzioni
Riassunto / Abstract
La reazione di isomerizzazione cis – trans che porta alla formazione dell’acido fumarico a partire dall’acido maleico viene catalizzata attraverso l'addizione di un bromo radicale generato per attivazione con luce ultravioletta usando una lampada UV (356nm), (figura 1)
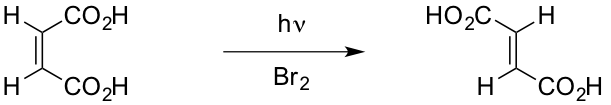
Si osserva la precipitazione di acido fumarico meno solubile in acqua. Questo può essere filtrato e quantificato dopo essiccazione.
Scheda sintetica delle attività
L'acido maleico è un acido bicarbossilico a configurazione Z avente un'elevata tensione dovuta all'ingombro sterico dei due gurppi carbossilici. Ciò nonostante è un composto stabile a causa dell'elevata energia necessaria per la rottura del legame π.
Quando si pone una quantità catalitica di bromo in soluzione inerte e si irradia con luce ultravioletta, il bromo molecolare si scinde in due radicali bromo. Il doppio legame subisce quindi un'addizione omolitica di radicale bromo che produce la rottura del doppio legame e la formazione di un radicale al carbonio.
Data la bassa concentrazione di radicale bromo in soluzione la reazione produce la rotazione del legame C-C e la formazione del conformero più stabile. La successiva eliminazione di bromo radicare porta alla formazione dell'acido fumarico conformazionalmente meno tensionato. Questo acido, meno solubile in acqua, precipita e può essere filtrato, essiccato e quantificato. Avendo un apparecchio per la determinazione dei punti di fusione si può concludere la reazione determinando il punto di fusone dei due acidi.
Quando si pone una quantità catalitica di bromo in soluzione inerte e si irradia con luce ultravioletta, il bromo molecolare si scinde in due radicali bromo. Il doppio legame subisce quindi un'addizione omolitica di radicale bromo che produce la rottura del doppio legame e la formazione di un radicale al carbonio.
Data la bassa concentrazione di radicale bromo in soluzione la reazione produce la rotazione del legame C-C e la formazione del conformero più stabile. La successiva eliminazione di bromo radicare porta alla formazione dell'acido fumarico conformazionalmente meno tensionato. Questo acido, meno solubile in acqua, precipita e può essere filtrato, essiccato e quantificato. Avendo un apparecchio per la determinazione dei punti di fusione si può concludere la reazione determinando il punto di fusone dei due acidi.
Risorse necessarie
- Acido Maleico, $C_4H_4O_4$;
- bromo, $Br_2$;
- 1 becker da 50 mL;
- 1 cilindro da 50 mL;
- 1 bacchetta di vetro;
- lampada UV (356 nm);
- pompa da vuoto ad acqua.
Prerequisiti necessari
- conoscenza delle strutture e delle conformazioni delle molecole organiche;
- saper scrivere e analizzare un profilo energetico di una reazione chimica (coordinata di reazione);
- conoscenza di reazioni radicaliche;
- saper scrivere il meccanismo di una reazione;
- saper analizzare le differenze di $pK_a$ e di solubilità.
Obiettivi di apprendimento
- Identificare la differenza tra reazione spontanea e catalizzata;
- analizzare come le differenze strutturali di due composti organici portino a differenti caratteristiche chimico-fisiche;
- capire l’importanza dell’interazione radiazione materia per le reazioni radicaliche.
Dotazioni di sicurezza
Reazioni da effettuare con i dispositivi di protezione individuale. si utilizza una soluzione di acqua di bromo tossica per inalazione che deve essere usata sotto cappa.
Svolgimento
Discussione iniziale
È opportuno accertarsi che gli studenti abbiano i prerequisiti necessari sopra citati per poter affrontare al meglio l’esperienza.
Si illustrano ai ragazzi i composti chimici che si andranno ad utilizzare nell’esperienza.
In particolare è necessario avvertire i ragazzi della pericolosità del $Br_2$, data la sua volatilità e tossicità. Le gocce di soluzione di bromo saranno aggiunte dal docente.
Sarà possibile a questo punto descrivere nel dettaglio l’esperienza. Ad ogni studente sarà consegnata poi un scheda operativa comprendente il materiale necessario, la procedura operativa e le domande di verifica in itinere (vedi allegato).
Si cercherà di far ragionare i ragazzi su:
- le differenti proprietà di isomeri diversi quali l'acido maleico e fumarico (pKa dei due acidi, differenti punti di fusione e loro differente solubilità in acqua) cercando di farli giungere da soli al perché delle differenze chimico-fisiche riscontrate, dovute essenzialmente alla possibilità di differenti legami idrogeno intra- (maleico) e intermolecolari (fumarico);
- quali procedure possono essere usate per isomerizzare il doppio legame (calore? reazione acido catalizzata? ricordate che il doppio legame è disattivato dai due gruppi carbossilici elettron attrattori!!);
- introdurre l'ipotesi di una reazioni radicalica e progettare quali possano essere le condizioni migliori affinché si abbia come prodotto l'isomero trans e non il dibromo derivato (quantità catalitiche di bromo diminuiscono la formazione di questo prodotto indesiderato!!).
A questo punto si proporranno delle possibili reazioni:
una reazione aggiungendo il $Br_2$ in quantità catalitica e irradiando con la lampada UV
una reazione aggiungendo il $Br_2$ in quantità stechiometrica e irradiando con la lampada UV
una reazione non irradiando con la lampada UV
una reazione non aggiungendo il $Br_2$.
una reazione aggiungendo il $Br_2$ in quantità stechiometrica e irradiando con la lampada UV
una reazione non irradiando con la lampada UV
una reazione non aggiungendo il $Br_2$.
Così facendo sarà evidenziabile la necessità di entrambi gli elementi affinché la reazione avvenga e l'obbligo di usare quantità catalitiche di bromo per diminuire reazioni collaterali ed abbassare la resa.
Prima dell’esperienza di laboratorio si deve far presente ai ragazzi che è fondamentale prendere appunti chiari di tutti i passaggi (possibilmente su un quaderno di laboratorio dedicato alle esperienze pratiche).
Procedura
In figura 2 è rappresentata la postazione di lavoro con la vetreria necessaria.

I due isomeri configurazionali in esame sono l’acido maleico e l’acido fumarico (figura 3).
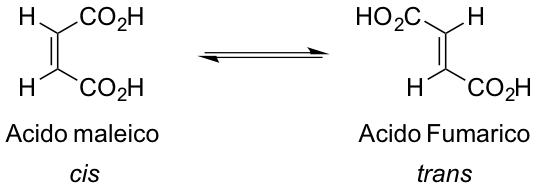
Come mostrato in figura 3 l’acido maleico presenta i due gruppi carbossilii dalla stessa parte del doppio legame ed è quindi in configurazione cis. Contrariamente l’acido fumarico presenta i gruppi carbossilici da parti opposte del doppio legame e quindi in trans. Si sta trattando quindi un isomeria di tipo stereochimico, in quanto la libera rotazione intorno al doppio legame è impedita dagli elettroni del legame $\pi$.
La reazione di isomerizzazione che porta dall’acido maleico è una reazione radicalica in cui l’iniziatore è il radicale bromo generato dalla rottura omolitica del legame $Br-Br$ ad opera della radiazione UV. Quindi una volta aggiunto il bromo ad una soluzione acquosa di acido maleico questa deve essere irradiata da una radiazione ultravioletta per far sì che avvenga la reazione (figura 4).

Il meccanismo della reazione è illustrato in Figura 5.
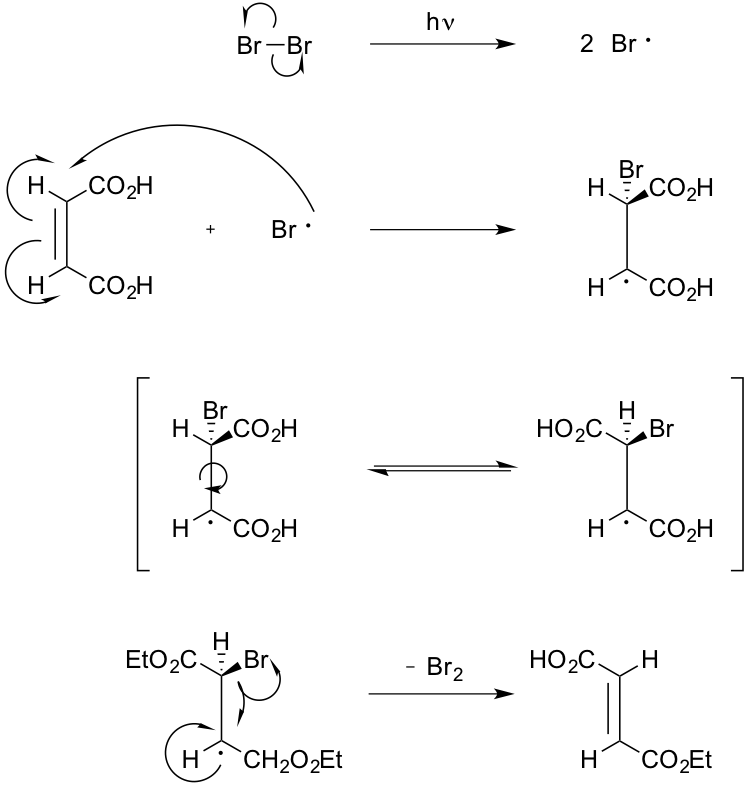
.
Possiamo osservare che la reazione procede verso i prodotti con la formazione di un precipitato cristallino, l’acido fumarico che è notevolmente meno solubile in acqua (figura 6). Dopo circa quindici minuti sarà possibile filtrare la soluzione su un filtro di carta (meglio in gooch con pompa da vuoto ad acqua). Il precipitato dovrà essere lascato essiccare in stufa o all'aria per alcuni giorni e potrà essere successivamente pesato, calcolando quindi la resa della reazione.
Avendo a disposizione un apparecchio didattico per il punto di fusione si potranno determinare i punti di fusione dell'acido moleico e fumarico. L'acido maleico in realtà non arriva al punto di fusione (137-140°C) ma disidrata formando anidride maleica. L'acido fumarico fonde a 298-300°C.

La driving force della reazione, che sposta l’equilibrio completamente alla formazione di uno dei due isomeri, è dovuto a:
- maggiore stabilità dell’acido fumarico, circa 7kcal/mol di ΔG.
- minore solubilità dell’acido fumarico in acqua
La differenza di energia libera dei due isomeri è riconducibile alle interazioni destabilizzanti dovute all'ingombro sterico dei due sostituenti carbossilici. Infatti, considerando i radicali intermedi di reazione, rappresentati tramite le proiezioni di Newman (Figura 7) possiamo notare la presenza di repulsioni steriche che destabilizzano la struttura "pseudo cis" derivante dall’acido maleico che spostano l'equilibrio conformazionale verso la formazione dell’altro intermedio "pseudo trans".

Una volta formato, l’acido fumarico precipita, perché meno solubile. La minore solubilità dell’acido fumarico è dovuta ad una maggiore interazione intermolecolare, mediante legami idrogeno, che favorisce la formazione del solido cristallino. La precipitazione sposta l’equilibrio della reazione portandola rapidamente a completezza.
Discussione finale
È importante basare la discussione finale sul rapporto fra la struttura dei due isomeri e le loro caratteristiche chimico-fisiche ricavabili da questo tipo di esperimento.
In particolare l'esperienza dovrebbe aver chiarito:
- il possibile meccanismo di reazione (vedi allegato profilo energetico);
- il ruolo del bromo e della luce UV nella reazione;
- il motivo per cui le altre due reazioni provate in assenza di un reagente non avvengono;
- la maggiore stabilità dell’acido fumarico, che infatti sposta l’equilibrio verso la formazione di quest’ultimo;
- lo spostamento ulteriore della equilibrio di reazione verso il prodotto a causa della minore solubilità in acqua dell'acido fumarico.
Bibliografia
Autori
Tofani Daniela

