Pannolino superassorbente: il segreto dei pannolini monouso
-
Chimica
-
Classi: 2° biennio e 5° anno
-
-
-
Strumentazione di base
-
Esperimento
-
1 h
-
Min. 1 persona
-
Richiede precauzioni
Riassunto / Abstract
In questa attività gli studenti analizzano le componenti polimeriche presenti nei pannolini monouso per bambini composto principalmente da polimeri sintetici. Tra questi riveste particolare importanza il poliacrilato di sodio usato per aumentare la capacità assorbente del pannolino. Questo polimero appartiene ai cosiddetti materiali polimerici intelligenti la cui struttura può essere modificata dalle condizioni in cui si trova (solvente, tipi di sali e loro concentrazione, pH). L’esperienza è divertente da fare, ed i risultati sono chiari e facili da vedere.
Scheda sintetica delle attività
Attraverso l’uso di forbici e di un sacchetto di plastica, si estrarrà dal pannolino il sale in esso contenuto: il poliacrilato di sodio. Dopo averlo pesato e posto in un contenitore sarà aggiunta acqua distillata colorata fino a raggiungere la massima quantità che il sale può assorbire. In questo modo è possibile calcolare la capacità assorbente del sale. Alla fine si aggiungerà sale da cucina per dimostrare la reversibilità della reazione. A conclusione della esperienza i gruppi di lavoro elaboreranno i dati raccolti che saranno utilizzati per la discussione in classe
Risorse necessarie
- Pannolino per bambini;
- forbici;
- sacchetti gelo da 4 L;
- becher (250 mL);
- bilancia;
- acqua distillata, 1500 ml per gruppo;
- colorante per dolci;
- becher di grandi dimensioni o bacinella;
- cilindro graduato;
- boccale in plastica;
- guanti in lattice;
- occhiali da laboratorio;
- sale ($NaCl$);
- cucchiai di plastica usa e getta;
- bacchetta per agitazione.
Prerequisiti necessari
- Possedere le conoscenze di base relative al legame ionico e covalente, alle reazioni reversibili;
- possedere le conoscenze di base sui polimeri;
- saper usare la strumentazione di base del laboratorio di chimica.
Obiettivi di apprendimento
- Conoscere il comportamento di materiali intelligenti - “smart materials”;
- verificare e quantificare la capacità assorbente del poliacrilato di sodio;
- comprendere le implicazioni chimico-fisiche della risposta del gel di poliacrilato ai cambiamenti della concentrazione ionica e di pH della soluzione.
Dotazioni di sicurezza
- Guanti;
- occhiali di protezione;
- camice.
Svolgimento
Introduzione
I pannolini monouso sono un miracolo della chimica moderna: la maggior parte dei materiali che li compongono sono polimeri sintetici. Il rivestimento esterno è composto da polietilene microporoso: trattiene l’urina ma permette la traspirazione. Il rivestimento interno è polipropilene: rimane morbido e asciutto e assorbe l’umidità della pelle. Tra questi due strati c’è poliacrilato di sodio in polvere insieme alla cellulosa che è l’unico materiale naturale usato. Il tutto è completato con alette di polipropilene idrofobico elasticizzato intorno alle cosce del bambino e due rettangoli di Velcro che mantengono il pannolino sul bambino.
L’ingrediente segreto del pannolino è il riempimento di poliacrilato di sodio (figura 2). Un polimero che appartiene agli idrogel: “materiali intelligenti” (smart materials) chiamati così perché si deformano quando c'è un cambiamento nel loro ambiente. In questo caso il cambiamento consiste nella variazione della concentrazione di ioni.

Quando è asciutto il poliacrilato di sodio ha i gruppi carbossilato associati a ioni sodio. Quando è in presenza di acqua, la pressione osmotica fa sì che le molecole di acqua entrino nel polimero. Quando l’acqua entra, gli ioni sodio si dissociano dal polimero, e le molecole di acqua, che sono polari, sono attratte da questi ioni positivi e dal carbossilato negativo del polimero. Allo stesso tempo, i gruppi carbossilato si respingono tra loro a causa della loro carica negativa, e si allontanano facendo svolgere il polimero (figura 3). Una prova dello svolgimento del polimero è il fatto che il pannolino si gonfia. Inoltre, poiché contiene molta acqua, il polimero diventa molto simile ad un gel.
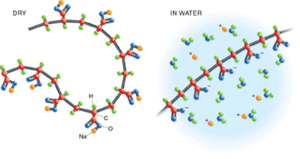
Il polimero è in equilibrio con l' acqua circostante. Questo equilibrio può essere disturbato in vari modi. Se la concentrazione ionica della soluzione viene aumentata - ad esempio mediante aggiunta di sale da cucina ($NaCl$) - gli ioni positivi del sale si legano ai siti negativi del polimero, neutralizzando efficacemente le cariche. Ciò fa sì che il polimero collassi su se stesso nuovamente ritornando solido. In particolare se si aggiungono sali dei metalli alcalino terrosi, come $CaCl_2$, la fuoriuscita di acqua avviene molto più velocemente a causa della forte interazione tra gruppi carichi della catena e gli ioni $Ca^{2+}$.
.jpg?1384708357)
Alcuni idrogel sono sensibili all'aggiunta di acidi o di basi. In questo caso l'aggiunta di un acido determina la precipitazione del polimero a causa della protonazione dei gruppi carbossilato (figura 4).
Procedura
Il polimero utilizzato in questa esperienza se da una parte è sensibile alle variazioni di concentrazione del sale, dall'altra non mostra alcun cambiamento al variare del pH.
- Tagliare con le forbici il rivestimento interno di polipropilene (figura 5a);

- Estrarre il contenuto, composto da cellulosa frammista a poliacrilato di sodio e trasferirlo dentro il sacchetto (figura 5b);
- ridurlo in piccole parti, chiudere il sacchetto e agitare vigorosamente così da favorire la separazione dei cristalli del sale dalla cellulosa. Ripetere questa operazione più volte eliminando di volta in volta i batuffoli di cotone ormai liberi dal sale
- raccogliere il sale in un becher e pesarlo e annotare il peso (figura 5c);
- versare il sale nella bacinella e, utilizzando un cilindro graduato, aggiungere acqua distillata colorata e mescolare (figura 6a);

- Il volume dei cristalli di gel aumenterà sempre di più all'aggiunta di acqua (figura 6b);
- aggiungere acqua distillata colorata fino a raggiungere la massima quantità che il sale può assorbire (figura 6c);
- prendere nota del volume di acqua totale assorbita al fine di calcolare la capacità assorbente del poliacrilato (figura 7a);

- aggiungere una cucchiaio da dessert di sale (figura 7b);
- mescolare e verificare l’effetto (figura 7c);
- si otterrà il risultato finale mostrato in figura 8: è ben distinguibile l'acqua che si è separata dai cristalli di gel.

Si può ripetere l'esperienza usando $CaCl_2$ oppure variando il pH della soluzione. Nel primo caso la fuoriuscita di acqua avviene più velocemente a causa della forte interazione tra gruppi carichi della catena e gli ioni $Ca^{2+}$. Nel secondo caso non si osserva alcun cambiamento al variare del pH.
Alla fine dell’esperienza i gruppi di lavoro risponderanno a dei quesiti proposti ed elaboreranno una presentazione con il materiale bibliografico e fotografico raccolto (vedi allegati) che sarà utilizzata per la discussione in classe.
Bibliografia
- Chimica – Kotz, Treichel, Weaver – Edizioni Edises - Terza Edizione 2007;
- Learn Chemestry: http://www.rsc.org/learn-chemistry/wiki/Lab:Experiments
- Sodium polyacrylate: http://en.wikipedia.org/wiki/Sodium_polyacrylate;
- Superabsorbent polymer: http://en.wikipedia.org/wiki/Superabsorbent_polymer;
- Osmotic Swelling of Polyacrylate Hydrogels in Physiological
- Salt Solutions: http://stbb.nichd.nih.gov/pdf/Polyacrylate_osmotic.pdf.
Autori
Micieli Giuseppe

