Le proprietà delle membrane: la pressione osmotica
-
Biologia
-
Classi: 2° biennio
-
-
-
Strumentazione di base
-
Esperimento
-
2 h
-
Min. 3 persone
-
Richiede precauzioni
Riassunto / Abstract
Questa attività sperimentale verifica alcuni aspetti dei fenomeni osmotici utilizzando membrane da dialisi. Gli studenti constateranno che una membrana da dialisi si lascia attraversare da molecole piccole (acqua, iodio, glucosio), ma non da molecole grosse (amido). Verificheranno che, quando nei due compartimenti delimitati dalla membrana, è presente una differenza di concentrazione di un soluto, si genera un flusso d'acqua verso la soluzione più concentrata con lo sviluppo di una pressione "osmotica". Osserveranno che il livello della soluzione ipertonica aumenta mentre quello della soluzione ipotonica diminuisce finché la pressione idrostatica e quella osmotica non saranno eguali. A questo punto le molecole del solvente avranno la stessa tendenza ad attraversare la membrana nei due sensi e la pressione osmotica potrà essere calcolata con la legge di Stevino.
Scheda sintetica delle attività
L’esperienza si articola in due fasi
Fase 1: evidenziare le proprietà della membrana da dialisi (eseguita dai singoli gruppi)
Si realizza un sacchetto con circa 20 cm di tubo da dialisi e vi si introducono 5ml di soluzione di glucosio all’8% m/m e 10 ml di salda d’amido. Si immergere il sacchetto in un becher riempito di acqua distillata cui è stata aggiunta la soluzione di iodio fino a che il colore dell’acqua non assuma colore giallognolo. Dopo 24 ore circa, il sacchetto appare più gonfio e la soluzione al suo interno colorata di blu, per la diffusione in esso di acqua e di iodio, mentre il liquido nel becher risulta incolore. Aggiungendo il reattivo di Fehling a qualche millilitro del liquido contenuto nel becher e riscaldando, si può verificare la presenza in esso di glucosio e quindi la sua diffusione dal sacchetto all’acqua contenuta nel becher.
Fase 2: calcolare la pressione osmotica determinata da una soluzione di amido (eseguita da alcuni studenti a gruppi riuniti).
Si pesa un volume noto di salda d’amido e si calcola la densità della soluzione. Si inserisce la soluzione di amido in un osmometro, con l’imboccatura ricoperta dalla membrana da dialisi. Quando si immerge l’estremità del tubo nel becher contenente acqua distillata, il solvente passa dal becher al tubo attraverso la membrana. Il passaggio prosegue finché l’innalzamento del liquido nel tubicino raggiunge un certo valore h. A questo punto il sistema è in equilibrio e dal valore misurato di h e da quello della densità, si calcola la pressione osmotica, utilizzando la legge di Stevino.
Questa attività laboratoriale si inserisce in un percorso sui trasporti diffusivi. Gli studi eseguiti nelle precedenti sperimentazioni sui tessuti vegetali (plamolisi e deplasmolisi di cellule di Elodea e di cellule di epidermide di cipolla; osmosi in tuberi di patata a contatto con soluzioni a diversa concentrazione di saccarosio) hanno fatto sorgere problematiche circa la possibilità di determinare quantitativamente la pressione osmotica e il ruolo funzionale che tale proprietà ha nei processi biologici del corpo umano. Obiettivo della presente sperimentazione è cercare una risposta alla prima domanda mediante l'uso di un modello che si basa sul concetto di sistema e di interfaccia. Tale modello potrà essere utilizzato, come punto di partenza, per descrivere, interpretare e prevedere l'evoluzione dei fenomeni nei quali sono presenti trasporti di tipo conduttivo, come il trasporto massivo e diffusivo di sostanze, legato all'apparato cardiovascolare.
Risorse necessarie
Fase 1
- Glucosio;
- amido solubile;
- bilancia (sensibilità 0,001g; portata 300g);
- 1 cilindro graduato da 100ml e 1 da 1000ml;
- acqua distillata;
- 2 becher da 200ml e 1 becher da 600ml e 1 da 1000ml;
- bacchette di vetro;
- becco Bunsen;
- sostegno a treppiede;
- reticella refrattaria;
- imbuto e carta da filtro;
- 20cm circa di tubo da dialisi (diametro 5 cm);
- filo di cotone resistente;
- 2 contagocce;
- 6 provette;
- 2 pipette graduate da 5 ml e 2 da 10 ml;
- tintura di iodio all’1% o reattivo di Lugol, soluzione acquosa di I2 e di KI. Si prepara introducendo in una provetta contenente 10 ml di acqua distillata 1g di iodio e 1 g di ioduro di potassio. Si agita con una bacchetta fino a quando lo iodio passa in soluzione in seguito alla formazione di un complesso
$I_2 + I^- \longrightarrow I^-_3$
- reattivo di Fehling. Il reattivo di Fehling è costituito da due soluzioni A e B che si mescolano al momento dell'uso. La soluzione A è preparata aggiungendo a 36,46g di CuSO4 ⋅ 5H2O 2 0,5 ml di H2SO4 diluito e acqua distillata fino a 500ml. La soluzione B è preparata aggiungendo a 173g di sale di Seignette (tartrato di potassio e di sodio) 60g di NaOH e acqua distillata fino a 500ml. Quando si mescolano i due reattivi, gli ioni rameici non precipitano come Cu(OH)2 perché formano un ione complesso con lo ione tartrato.
Fase 2
- Bilancia (sensibiltà 0,001g, portata 200g);
- cilindro graduato da 100ml;
- osmometro (in alternativa un contenitore di plastica a cui, in corrispondenza del tappo, applicare la membrana da dialisi e, sul fondo, praticare un foro dove inserire e saldare un tubicino di vetro);
- tubo da dialisi (diametro 5 cm);
- parafilm;
- elastico;
- 250ml della soluzione d'amido preparata per il primo esperimento;
- sostegno;
- 2 becher da 400ml;
- imbutino;
- acqua distillata;
- riga (sensibilità 0,1cm; portata 50 cm).
Prerequisiti necessari
- Conoscere la struttura e le funzioni della membrana plasmatica;
- conoscere i fenomeni di diffusione ed osmosi nelle cellule eucariotiche;
- conoscere la prima legge di Fick, la legge di Stevino e il principio di Pascal;
- saper utilizzare strumenti di misura;
- saper preparare soluzioni a concentrazione nota;
- saper distinguere fenomeni fisici e chimici.
Obiettivi di apprendimento
- Esprimere i concetti acquisiti con terminologia e simbolismo appropriato;
- individuare gli elementi e gli aspetti rilevanti di un fenomeno;
- saper applicare le conoscenze in situazioni nuove;
- saper collocare le informazioni nel contesto di riferimento;
- saper organizzare l'attività di laboratorio.
Dotazioni di sicurezza
Le fonti di rischio sono le apparecchiature di riscaldamento (becco Bunsen), la vetreria, che se si rompe diventa tagliente e i reagenti. Norme generali di comportamento È necessario indossare il camice, gli occhiali di sicurezza e raccogliere i capelli sulla nuca, specialmente quando si lavora in prossimità di una fiamma. Occorre indossare i guanti in lattice quando si utilizzano reattivi e apparecchiature in vetro e i guanti ignifughi o usare le pinze, quando si manipolano corpi caldi o quando si opera con il becco Bunsen. Sicurezza nell’uso del becco Bunsen Prima di accendere la fiamma Bunsen, occorre accertarsi che non vi siano sostanze infiammabili nelle vicinanze. Accendere il Bunsen con prudenza: non aprire completamente il rubinetto di regolazione del gas, chiudere la ghiera per l’entrata dell’aria e avvicinare il fiammifero lateralmente all’estremità superiore del cannello. A fori aperti la fiamma è azzurra e poco visibile e molto calda; a fori chiusi, la fiamma è gialla e luminosa, poco calda. Il becco Bunsen deve essere tenuto acceso solo per il tempo necessario all’uso. Se ci si allontana momentaneamente, occorre rendere visibile e luminosa la fiamma ruotando opportunamente la ghiera. Le provette riscaldate, anche se a bagnomaria, non devono essere assolutamente chiuse e non si deve mai guardare al loro interno mentre vengono riscaldate. Precauzioni nella preparazione dei reattivi di Lugol e Fehling I reagenti sono sostanze pericolose per contatto, ingestione e inalazione. Per la preparazione dei reattivi occorre perciò lavorare sotto cappa aspirante. Tale compito è di competenza del docente o del tecnico di laboratorio. È necessario consultare le schede dei reagenti, reperibili ai seguenti link: http://www.zetalab.it/schede/x251774.pdf, http://www.zetalab.it/schede/x251563.pdf e http://www.zetalab.it/schede/x251564.pdf.
Svolgimento
Fase 1
- Preparare una soluzione di glucosio all’ 8% m/m.
- Preparare una soluzione di amido (salda d’amido), sciogliendo in un becher contenente 600ml di acqua distillata due cucchiaiate d’amido; scaldare e far bollire per 1-2minuti, fino a che il liquido non sia limpido e, dopo raffreddamento, filtrare in becher attraverso la carta da filtro. La soluzione deve avere una densità di circa 1g/cm3 perché, se troppo concentrata, raffreddandosi tende ad addensarsi. Inoltre, Il volume di soluzione da preparare è in funzione del numero dei gruppi di lavoro e della necessità, a volte, di dover ripetere le prove.
- Contrassegnare quattro provette con i numeri 1,2,3 e 4.
- Versare nelle provette 1 e 2 qualche millilitro della soluzione d’amido e nelle provette 3 e 4 qualche millilitro della soluzione di glucosio.
- Alle provette 1 e 3 aggiungere 2ml di soluzione A e 2 ml del di soluzione B del reattivo di Fehling: si otterrà una soluzione di colore azzurro per la presenza di Cu2+ . Scaldare le provette a bagnomaria sul bunsen fino alla comparsa di un precipitato di colore rossastro di CuO, che si osserverà solo nella provetta 3 dove è presente la soluzione di glucosio. Dopo la comparsa del precipitato rosso nella provetta 3, è necessario togliere le provette dal bagnomaria per evitare che, in seguito ad ulteriore riscaldamento, l'amido contenuto nella provetta 1 si idrolizzi e dia esito positivo al saggio di Fehling.
- Alle provette 2 e 4 aggiungere qualche goccia del reattivo di Lugol. Si osserverà la comparsa del colore blu solo nella provetta 2 contenente la soluzione di amido.

- Preparare un sacchetto col tubo da dialisi, legandolo strettamente col filo ad un’estremità. Introdurre nel sacchetto 5 ml di soluzione di glucosio e 10 ml di soluzione di amido e legare saldamente l’altra estremità del sacchetto. Conservare la soluzione restante di salda d’amido per il secondo esperimento.
- Introdurre il sacchetto in un becher da 600ml contenente acqua distillata e aggiungere a questa alcune gocce di tintura di iodio fino a che il colore dell’acqua non diventa giallognolo, rimescolando con la bacchetta di vetro (figura 1).
- Osservare attentamente quanto accade nei primi trenta minuti e dopo 24 ore circa.
- Dopo 24 ore, mescolare in una provetta qualche millilitro di liquido prelevato dal becher col reattivo di Fehling (2ml di soluzione A e 2 ml del di soluzione B):si otterrà una soluzione di colore azzurro per la presenza di Cu2+ .
- Scaldare la provetta a bagnomaria sul bunsen fino alla comparsa di un precipitato di colore rossastro di CuO (figura 2).

Osservazioni
Dopo 30 minuti circa la soluzione all’interno del sacchetto inizia a colorarsi di blu, mentre ciò non accade all’esterno (figura 3).
Dopo 30 minuti circa la soluzione all’interno del sacchetto inizia a colorarsi di blu, mentre ciò non accade all’esterno (figura 3).

Dopo 24 ore circa si osserva che (figura 4):
- il sacchetto appare più gonfio;
- la soluzione all’interno del sacchetto si è colorata intensamente di blu;
- il liquido nel becher è incolore.

La rielaborazione delle osservazioni e dei dati sperimentali viene introdotta da una serie di domande a cui gli studenti rispondono singolarmente o a gruppi. Le risposte fornite dagli studenti serviranno come stimolo per la discussione collettiva in cui l’insegnante coordina ed inquadra in uno schema logico le conoscenze acquisite, amplia l’argomento esaminato .
Domande
Che cosa provoca l’aumento di volume del sacchetto?
Evidentemente vi è stato un flusso netto di acqua dal becher al sacchetto: poiché la concentrazione di acqua è maggiore nel becher rispetto al sacchetto, il flusso in entrata è superiore a quello in uscita
Che cosa è accaduto allo iodio aggiunto all’acqua distillata contenuta nel becher? E all’amido? E al glucosio?
Come l’acqua, anche lo iodio è passato all’interno del sacchetto attraverso la membrana, come risulta dal fatto che la salda d’amido si colora sempre più intensamente di blu, mentre l’acqua contenuta nel becher gradualmente si schiarisce fino a diventare incolore. Ciò dimostra che l’amido non è riuscito ad attraversare la membrana da dialisi. L’esito positivo del liquido del becher al saggio con il reattivo di Fehling prova che il glucosio attraversa la membrana da dialisi.
I fisici possono dimostrare che le molecole di una stessa sostanza hanno tutte dimensioni simili, mentre quelle di sostanze diverse hanno dimensione diversa. Ed infatti le molecole di iodio e quelle di acqua hanno dimensioni molto piccole, le molecole di glucosio sono grandi e quelle di amido lo sono ancora di più. Tenendo conto di tutto ciò, quali considerazioni possono essere fatte circa la struttura della membrana da dialisi?
La membrana da dialisi, agendo come un filtro i cui pori consentono il passaggio solo delle specie chimiche di piccole dimensioni ma non delle macromolecole (amido), è quindi una membrana semipermeabile.
La membrana da dialisi, agendo come un filtro i cui pori consentono il passaggio solo delle specie chimiche di piccole dimensioni ma non delle macromolecole (amido), è quindi una membrana semipermeabile.
Fase 2

- Pesare 100 ml della soluzione di amido e calcolarne la densità.
- Tagliare un pezzetto di tubo da dialisi lungo un lato in modo da ottenere una membrana di forma quadrata e di dimensioni di poco superiori al diametro dell’imboccatura dell’osmometro (parte bassa del tubo).
- Fissare accuratamente con un elastico e con il parafilm la membrana semipermeabile all’imboccatura dell’osmometro assicurandosi che aderisca perfettamente al tubo.
- Versare la soluzione d’amido attraverso il tubo dell’osmometro mediante un imbutino.
- Immergere l’estremità bassa del tubo a cui è stata fissata la membrana da dialisi in un becher da 400 ml contenente acqua distillata.
- Fissare l’osmometro ad un sostegno e segnare con un pennarello il livello iniziale della soluzione nell’osmometro.
- Osservare le variazioni del livello della soluzione nel tubo nelle successive 24 ore/72 ore.
- Misurare l’altezza della soluzione h raggiunta dalla soluzione nel tubo rispetto al livello dell’acqua distillata nel becher, quando non si registra più alcuna variazione del livello della soluzione nel tubo.
- Calcolare la pressione osmotica in Pascal e in atmosfere esercitata dalla soluzione d’amido applicando la legge di Stevino
OSSERVAZIONI
Il livello del liquido nel tubicino aumenta nell’arco delle 72 ore fino a raggiungere un’altezza h di 11,0 cm oltre la quale, nelle ore successive, non si registra più alcuna variazione (figuraa 6)
Il livello del liquido nel tubicino aumenta nell’arco delle 72 ore fino a raggiungere un’altezza h di 11,0 cm oltre la quale, nelle ore successive, non si registra più alcuna variazione (figuraa 6)

Domande
Che cosa impedisce al liquido nel tubicino di salire indefinitamente?
La membrana semipermeabile, come già dimostrato nel 1° esperimento, può essere attraversata dalle molecole di solvente (acqua) ma non da quelle di soluto (amido). Ciò determina un passaggio netto di solvente dal becher in cui è contenuta l’acqua distillata all’osmometro in cui è contenuta la salda d’amido. Il passaggio prosegue finché l’innalzamento del livello del liquido nel tubicino, raggiunto un certo valore h, provoca una pressione idrostatica nella soluzione che si oppone ad ogni ulteriore passaggio. A questo punto il sistema è in equilibrio dinamico e le molecole di solvente passano attraverso la membrana in entrambe le direzioni con la stessa velocità.
Schematizzare il flusso di acqua attraverso la membrana e, a equilibrio raggiunto, le pressioni prodotte dai fluidi sulla membrana da dialisi. Ricavare, infine, la relazione matematica che consente di calcolare la pressione esercitata dalla soluzione di amido.
A livello della membrana da dialisi, di cui sotto è ingrandito un poro, si ha un flusso netto di acqua dal poro, po, (dove sono presenti solo molecole d'acqua) a B, secondo la legge di Fick, in conseguenza del gradiente di concentrazione di acqua. Ciò crea una diminuzione di pressione idrostatica all'apice (b) del poro e una differenza di pressione idrostatica, Δp, tra a e b. Questa Δp, dovuta ad una differenza di pressione osmotica, genera un flusso netto di acqua tra A e B.
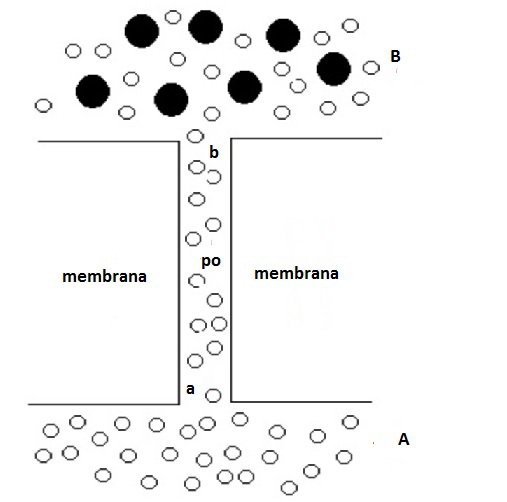
A livello della membrana agiscono dall'alto verso il basso una pressione pari alla somma della pressione atmosferica (per il principio di Pascal), $p_A$, e della sovrappressione idrostatica (per la legge di Stevino), ρgh, e dal basso verso l'alto una pressione pari alla somma della pressione atmosferica (per il principio di Pascal), $p_A$, e della pressione osmotica, $\pi$, (le due superfici libere sono entrambe a pressione atmosferica). Una volta raggiunto l'equilibrio, il dislivello misura la pressione osmotica di una soluzione più diluita di quella originale. Si può rendere questa diluizione trascurabile utilizzando un tubo di diametro molto piccolo per l'ascensione del liquido. In queste condizioni, si può affermare che la pressione idrostatica dovuta al dislivello, misura la pressione osmotica della soluzione primitiva.
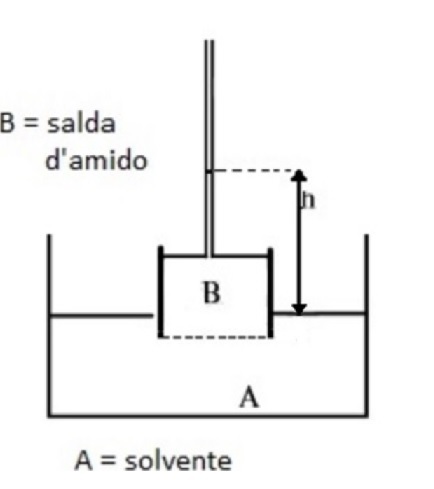
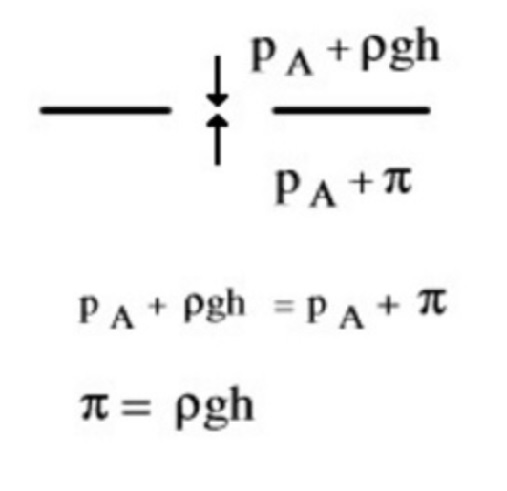
All’equilibrio la pressione esercitata dalla colonna h di liquido corrisponde alla pressione osmotica della soluzione:
$$\pi = \rho gh$$
dove $\rho$ è la densità della soluzione e $g = 9,807\ m/s^2$ è l’accelerazione di gravità.
Risulta: $$\rho = \frac{m}{V}=\frac{99,800}{100}\frac{g}{ml} = 0,998 \cdot 10^3\ kg/m^3 \longrightarrow$$
$$\pi = (0,998 \cdot 10^3 kg/ m^3) \cdot (9,807\ m/s^2) \cdot (0,110\ m) = 1,08 Pa = \frac{1,08}{1,013 \cdot 10^5} atm = 0,0107\ atm$$
$$\pi = \rho gh$$
dove $\rho$ è la densità della soluzione e $g = 9,807\ m/s^2$ è l’accelerazione di gravità.
Risulta: $$\rho = \frac{m}{V}=\frac{99,800}{100}\frac{g}{ml} = 0,998 \cdot 10^3\ kg/m^3 \longrightarrow$$
$$\pi = (0,998 \cdot 10^3 kg/ m^3) \cdot (9,807\ m/s^2) \cdot (0,110\ m) = 1,08 Pa = \frac{1,08}{1,013 \cdot 10^5} atm = 0,0107\ atm$$
Note e storia
Legge di Fick: la velocità di diffusione di una sostanza attraverso una membrana è proporzionale all’area della membrana, alla solubilità della sostanza nella membrana, al gradiente di concentrazione ed è inversamente proporzionale allo spessore della membrana e alla radice quadrata della massa molecolare della sostanza.
Legge di Stevino: in un liquido incomprimibile sottoposto alla sola forza di gravità e contenuto in un recipiente aperto, la pressione in ogni punto interno al liquido è direttamente proporzionale al peso della colonna di liquido soprastante, e quindi all'altezza di questa ultima, alla densità del fluido e all’ accelerazione di gravità, ma è totalmente indipendente dalle dimensioni o dalla forma del contenitore.
Principio di Pascal: la pressione esercitata in un punto qualsiasi di un fluido si trasmette in ogni altro punto del fluido con la stessa intensità, indipendentemente dalla direzione.
Il reattivo di Lugol è una soluzione acquosa iodo-iodurata di colore marrone chiaro, inodore. In soluzione, lo ioduro di potassio di dissocia secondo la reazione:
$$I_2 + KI \longrightarrow I^-_3 + K^+$$
$$I_2 + KI \longrightarrow I^-_3 + K^+$$
Lo ione $I^-_3$ tende a complessarsi con l'amilosio, componente insieme all'amilopectina dell'amido, legandosi alla parte interna della catena elicoidale dello stesso. Il complesso risultante assorbe la luce, producendo una decisa colorazione verso il blu scuro. In realtà, quindi, tra amido e iodio non si verifica una vera e propria reazione chimica, ma semplicemente, le molecole di iodio restano adsorbite tra le catene dell'amido.
Reattivo di Fehling:il saggio si basa sul potere riducente del gruppo aldeidico $-CHO$ libero del glucosio che riesce a ridurre lo ione $Cu^{2+}$ del solfato rameico a ione $Cu^+$ facendolo precipitare sotto forma di ossido rameoso rosso, giallo oppure verde a seconda della quantità di ossido rameoso che si forma, mentre il gruppo aldeidico si ossida a gruppo carbossilico. La reazione è la seguente:
$$ R-CHO + 2OH^- \longrightarrow R-COOH + H_2O + 2e^-$$
$$2Cu^{2+} + 2e^- \longrightarrow 2Cu^+$$
$$\frac{2Cu^+ + 2OH^- \longrightarrow Cu_2O + H_2O}{R-CHO + 2Cu{2+} + 4OH^- \longrightarrow R-COOH + Cu_2O +2H_2O}$$
$$ R-CHO + 2OH^- \longrightarrow R-COOH + H_2O + 2e^-$$
$$2Cu^{2+} + 2e^- \longrightarrow 2Cu^+$$
$$\frac{2Cu^+ + 2OH^- \longrightarrow Cu_2O + H_2O}{R-CHO + 2Cu{2+} + 4OH^- \longrightarrow R-COOH + Cu_2O +2H_2O}$$
Bibliografia
- BSCS -Edizione breve di BSCS VERDE- Ricerche di laboratorio- Zanichelli;
- A. Post Baracchi, A. Tagliabue, CHIMICA- Attività sperimentali- Lattes;
- www.univpm.it/Entra/download/.../Complementi_di_Fisica_Medica.pdf.
Autori
Riccio Daniela

